|
"БАД-Бизнес" -
декабрь 2005 г.
По аналогии с предпоследним выпуском ББ, декабрьский номер мы начинаем с обзора
важных для отрасли событий, тем более что их направленность в значительной
степени соответствовала содержанию бюллетеня в течение всего прошедшего года.
Итак, семинар «Нормативное
регулирование рынка биологически активных добавок к пище и вопросы их
добровольной сертификации», дата
проведения 23.12.2005г., место проведения - Москва.
Темы докладов:
1
Биологически активные добавки к пище.
Нормативно-правовое регулирование в Российской Федерации
2
Государственный контроль и регистрация биологически
активных добавок к пище
3
Системы добровольной сертификации продукции и
Федеральный закон «О техническом регулировании»
4
Система добровольной сертификации биологически
активных добавок к пище
5
Юридические аспекты закона «О рекламе» для БАД
6
Принципы проведения клинической оценки эффективности
биологически активных добавок
7
Роль общественных организации на рынке БАД
Из
услышанного остановимся только на том, что отличалось хоть какой-то новизной и
не освещалось в бюллетене. Так, из первых двух докладов (представителей
Роспотребнадзора) стало известно, что в текущем (2005) году уже зарегистрировано
1800 биологически активных добавок к пище (на 9 декабря 2005 года), в 2002 г. –
1566, в 2003 г. – 1814, в 2004 г. - 2441). Таким образом, в настоящее время на
рынке РФ находится более 6000 биологически активных добавок к пище.
Из недр
института питания РАМН вышел и был доложен «Алгоритм
проведения
оценки
клинической
эффективности
БАД».
Он заключается, как видится автору, в
следующем:
ОПРЕДЕЛЕНИЕ
ДЕЙСТВУЮЩЕГО ВЕЩЕСТВА
ОПРЕДЕЛЕНИЕ
ПОКАЗАТЕЛЕЙ БЕЗОПАСНОСТИ
ДИНАМИКА
ОБЕСПЕЧЕННОСТИ БИОЛОГИЧЕСКИ АКТИВНЫМИ ВЕЩЕСТВАМИ
ДИНАМИКА
БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ
ДИНАМИКА
ИММУННОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ
ДИНАМИКА
ПОКАЗАТЕЛЕЙ АНТИОКСИДАНТНОГО СТАТУСА
ДИНАМИКА
ФИЗИОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ
1. Оценка
органолептических свойств БАД и их переносимости
1. Изучение
органолептических свойств исследуемых продуктов осуществляется с использованием
анкетно-опросного метода (вкус, запах, цвет, консистенция, наличие посторонних
примесей, запахов и т. д.)
2.
Переносимость исследуемых продуктов оценивается путем клинического наблюдения за
самочувствием, появлением побочных эффектов, состоянием кожных покровов, системы
пищеварения, сердечно-сосудистой системы, опорно-двигательного аппарата и других
органов и систем организма.
2. Анализ
пищевого статуса с использованием методов нутриметаболомики
1.Оценка
метаболического статуса:
2.Исследование состава тела (биоимпедансометрия и остеоденситометрия);
3.
Исследование основного обмена (ОО) и дыхательного коэффициента (ДК) методом
непрямой калориметрии;
4.Оценка
фактического питания добровольца с использованием компьютерной программы:
- определение
белковой квоты путем измерения баланса азота;
-
исследование биохимических маркеров пищевого и метаболического статуса.
3.
Клинико-функциональная оценка эффективности БАД:
- клинические
показатели;
- показатели
инструментальных методов исследования, характеризующие функциональное состояние
различных органов и систем;
- антропометрические показатели
(масса тела, индекс массы тела, окружность плеча, талии, бедер, толщина кожной
складки);
-
лабораторные показатели (общий анализ мочи, крови и др.).
Как представляется ББ, уже излагавшему общепринятые
принципы доказательной медицины, такой алгоритм может не найти
единодушной поддержки у научной общественности.
Ну и, наконец, последний доклад, сотворенный
Ассоциацией российских производителей БАД и СПП. Позволим себе процитировать его
наиболее значимые, на взгляд ББ, места, сохранив авторский язык, подчас весьма
оригинальный.
«Следует
выделить те организации, которые имеют наибольшее влияние на положение БАД в
России. В первую очередь, это Институт питания РАМН и РАМН в целом, затем
Федеральная служба РФ по надзору в сфере защиты прав потребителей и благополучия
человека, Ассоциация БАД, Минздравсоцразвития, комитет по здравоохранению
Госдумы РФ, комитет по образованию, науке и здоровью Совета Федерации РФ,
аптечные склады, аптечные объединения, Минпромэнергетики, МВД, средства массовой
информации и отдельные производители БАД».
«Сейчас в России действует более 400 предприятий,
производящих биологически активные добавки и находящихся под постоянным
контролем органов Роспотребнадзора».
«Договорились с Минздравом РФ об издании Реестра БАД и
выпустили его в 2005 году на базе «Литораль». Учитывая решение Минздрава о том,
что Реестр является официальным документом, констатирующим лишь формальные акты
регистрации БАД, договорились об издании Сборника комментариев к этому Реестру,
в котором могут быть изложены практические результаты исследований БАД и
какие-то рекомендации по целенаправленному их использованию».
«Члены Ассоциации получили информацию о протоколе
взаимодействия при осуществлении надзора (контроля) за производством и оборотом
БАД, подписанном 31.08.2004 г. руководителем Федеральной службы по надзору в
сфере защиты прав потребителей и благополучия человека господином Онищенко Г.Г.
и начальником Федеральной службы по экономическим и налоговым преступлениям
господином Веревкиным-Рахальским С.В.
Документ этот, безусловно, полезен для нас, так как направлен на повышение
достоверности рекламной информации и качества добавок, но, с другой стороны,
несколько тенденциозен, т.к. в своем первом пункте содержит раздел усиления
контроля за деятельностью производителей БАД, а не фальсификаторов, рвачей и
мошенников. Уже сегодня по указанию Минздравсоцразвития РФ местные органы
Роспотребнадзора ежеквартально проверяют и докладывают в Москву результаты
проверок предприятий и продукции – БАД, а еще одна проверка вряд ли приведет к
улучшению качества и обеспечения населения незаменимыми продуктами питания через
БАД».
«Ассоциация
БАД продолжила работу по борьбе с фальсификацией БАД, выработала с Федеральной
службой Роспотребнадзора единые подходы по оценке фальсификатов, все случаи
доводятся до сведения местных органов Роспотребнадзора для принятия мер и
усиления контроля».
«Если мы продолжим поэтапное продвижение биологически
активных добавок, к которым относятся не только источники витаминов и
минеральных добавок, но и жирные кислоты
w-3,
остродефицитные аминокислоты, пищевая клетчатка, то нет сомнения в том, что
успех будет сопутствовать нам, а это должно вылиться в увеличение
продолжительности и улучшение качества жизни людей, повышение благополучия и
снижение заболеваемости, инвалидизации и смертности населения».
«Для биологически активных добавок к пище сложности с
реализацией связаны с наличием, по крайней мере, пяти причин:
1. Работники системы здравоохранения, и в первую очередь
врачи, не получают должного образования в отношении возможности использования
биологически активных добавок к пище для поддержания здоровья населения, а по
сути – здравоохранения. Причем дефицит этих знаний не устраняется и на
последующих этапах повышения квалификации, что делает врачей сторонними
наблюдателями, имеющими на вооружении лишь лекарственные средства. Этот
кажущийся незначительным недостаток в образовании на самом деле является
важнейшим в багаже знаний, т.к. чтобы скрыть свою некомпетентность, многие
медицинские работники вынуждены пренебрежительно говорить о БАД, априори
обозначая их как неэффективные и бесполезные для здоровья. А это уже опасно для
общества. Ведь мы понимаем, что есть один врач и есть один человек. И врач
должен знать и подсказывать человеку, когда ему надо принимать БАД, а когда –
лекарства. Отдельного врача по использованию БАД и применению лекарств быть не
должно.
2. Недобросовестная, а порою и агрессивная реклама о
достоинствах БАД, вводящая население в заблуждение о лечебных свойствах этих
продуктов. Этот обман достаточно скоро выявляется, и людская молва быстро
распространяет негативную оценку БАД, причем эта оценка чаще всего касается уже
не конкретной добавки, а всей категории БАД. И понадобится много передач для
того, чтобы разубедить население в его представлениях о БАД и показать истинную
ценность этих продуктов для организма человека.
3. Отсутствие специализированного рынка БАД, недостаток
крупных оптовиков, наподобие Протека, СИА Интернешнл, Морон и ряда других,
специализирующихся на распространении в аптечной сети и специализированных
магазинах биологически активных добавок к пище.
4. Наличие искусственно созданной конкуренции между
фармпрепаратами и биологически активными добавками. А фактически, надо сказать,
речь идет о существовании серьезной озабоченности импортеров и лекарств и БАД в
связи с поднимающейся на ноги и уже заметно влияющей на финансовые потоки
аптечного и неаптечного рынков отечественной индустрии БАД. Ведь рынки
фармпрепаратов »4
млрд. $ в год и БАД »1
млрд. $ в год уже сопоставимы и становятся конкурентными в борьбе за карманы
населения.
5. Недостаток достоверной информации о биологически активных
добавках к пище, об их составе, свойствах, назначении и полезности. Это
положение возникло по двум причинам. В соответствии с требованиями СанПиН, при
регистрации БАД на этикетку БАД может выноситься информация только о составе,
определяющая этот продукт как источник витаминов, минералов или других факторов
питания, и заранее оговаривается, что не допускается упоминаний о свойствах
продукта, например, тонизирующего, послабляющего, общеукрепляющего и т.д. вне
зависимости от экспертного заключения НИИ питания. Таким образом, в соответствии
с законом о рекламе становится невозможной информация о выявленных в результате
клинических исследований полезных свойствах конкретного БАД, позволяющая
населению сделать для себя выбор наиболее привлекательной добавки с учетом
состояния здоровья конкретного потребителя. И вторая причина кроется в том, что
по положению о регистрации БАД регистрационные свидетельства Роспотребнадзора РФ
являются подтверждением лишь безопасности продукта, но не эффективности и
специфической полезности продукта.
Большую надежду мы возлагаем на
решение о добровольной сертификации БАД с отражением в сертификатах соответствия
эффективности добавок, подтвержденных клиническими исследованиями».
«Знание тормозящих продвижение БАД факторов позволяет нам
продумывать и находить пути преодоления этих трудностей. В этой творческой
работе большое значение имеет характер сложившихся взаимоотношений руководства
федеральной службы «Роспотребнадзор» и Ассоциации БАД.
Доброжелательная обстановка позволила нам найти ответ на
многие вопросы через формируемую систему добровольной сертификации БАД.
Сертификаты соответствия смогут вместить в себя не только оценку показателей
качества, но и эффективности по результатам клинических исследований БАД. И
чтобы не идти на выяснение отношений с фармакологическим комитетом, тщательно
оберегающим свою монополию на оценку терапевтической активности любых средств
воздействия на организм человека, в системе добровольной сертификации
необходимо оценивать эффективность по влиянию БАД на физиологические системы
организма. Работа эта еще не завершена, но мы надеемся, что уже до конца 2005
года она начнет функционировать.
К сожалению, ряд организаций в
соответствии с федеральным законом «о техническом регулировании» спешно оформили
и зарегистрировали свои системы добровольной сертификации и уже начали выдавать
заявителям свои документы. Но должен отметить, что эти пионеры не могут и сами
ответить на вопросы об аккредитации, о стройной системе регистрации, контроля,
обучения, обжалования, экспертизы, компетентности и т.д. Без методического
объединения различных органов сертификации и единых правил оформления документов
мы не продвинемся и не добьемся успехов. Поэтому спешащим к пирогу руководителям
мы рекомендуем проявить терпение и начать свою деятельность лишь после
согласования своей компетенции с центральным органом сертификации, строящем свою
работу в тесной взаимосвязи с федеральной службой «Роспотребнадзор» и
федеральным Агентством по техническому регулированию и метрологии».
Как видно из цитируемого, важное место в докладе
заняла тема добровольной сертификации БАД, проводимая в рамках реформы
технического регулирования. Но вот интерпретация этой реформы дается
Ассоциацией весьма своеобразно, свидетельством чему – материалы
интернет-пресс-конференции, посвященной ходу
реализации реформы технического регулирования и состоявшейся в пресс-центре РБК.
По странному совпадению – примерно в то же время, что и семинар.
В конференции участвовали: руководитель
Экономической рабочей группы при администрации президента РФ Антон
Викторович Данилов-Данильян и председатель правления Национального института
технического регулирования Александр Вадимович Рубцов.
Они указали, в частности, на следующее:
А.Данилов-Данильян:
«Главная причина торможения реформы - это попытка реакционной бюрократии,
по-другому я ее назвать не могу, пересмотреть основополагающие принципы закона о
техническом регулировании, т.е. идеологию самой реформы. И это отвлекает
инициативные группы, инициативные советы от разработки конкретных, специальных,
технических регламентов в их отраслях. Идет постоянная дезинформация в различных
СМИ, идет неправильное методическое сопровождение реализации реформы, когда
некоторые, скажем так, политические действия, политические соглашения выдаются
за нормативные акты. Самое главное, что даже в тех случаях, когда бюрократия,
оказывая воздействие на инициативные группы, соглашается с подготовкой
технических регламентов, тем не менее, построение этих законов оказывается не
таким, как это предусмотрено в законе о техническом регулировании, а таким,
какой выгоден этой бюрократии. А что выгодно бюрократии? Чтобы вот эти
обязательные требования устанавливала она, а не общество».
А.Рубцов: «В
законе о техническом регулировании есть несколько конкретных запретов
функционального свойства. Я зачитаю: "Независимость органов по аккредитации,
органов по сертификации от изготовителей, продавцов, исполнителей и
приобретателей". То есть, понятен этот запрет. Это запрет на определенного рода
связи. "Недопустимы ограничения конкуренции при осуществлении аккредитации и
сертификации". Это запрет на монополию в этом виде деятельности. "Недопустимо и
совмещение полномочий органа государственного контроля и органа по сертификации".
Если я выдаю сертификат, а потом сам себя контролирую, понятно, что из этого
бывает. "Недопустимость и совмещение одним органом полномочий на аккредитацию и
сертификацию". То есть я аккредитовал лабораторию, и сам же еще осуществляю эти
функции, а всех остальных просто не аккредитую, чтобы остаться самому на этом
рынке. Вот это очень важные запреты. Они позволяют оптимизировать ситуацию».
Таким образом, что-то не
состыковывается у Ассоциации производителей БАД с реформаторами. А именно – не
может быть никакого «центрального органа сертификации», никакой монополизации
этой услуги, и тем более монополизации в союзе «центрального органа» с органом
государственного контроля. А в том, что т.н. «центральный орган» собрался идти
именно по этому пути, свидетельствует проект Знака соответствия предлагаемой
системы, на котором совершенно незатейливо написано по периметру – «Роспотребнадзор».
Т.е., как считает А. Рубцов, «…я выдаю сертификат, а потом сам себя
контролирую».
ББ отвечает на вопросы.
«Как в настоящее время
регламентируется использование лекарственных растений для производства
БАД? Сначала (2001) был список из 10 растений, запрещенных для получения
однокомпонентных
БАД. Потом к ним добавили (2002) еще почти 200. В то же время на многие
производители, как представляется, игнорируют эти ограничения».
Видимо, эта тема заслуживает обстоятельного
обсуждения ввиду своей очевидной важности. Так,
в 1997 году Комитет по контролю над пищевыми
продуктами и лекарственными средствами США (FDA)
начал расследование, касающееся безопасности употребления ключевого компонента
продуктов Гербалайф — экстракта китайского растения Ma Huang, или эфедры. Будучи
очень эффективным средством, помогающим снизить вес, Ma Huang обладает целым
рядом побочных эффектов: от затрудненного дыхания до снижения кровяного
давления. Пока же приводим точку зрения
регулярного участника наших дискуссий Шпекторова Григория Яковлевича из
Санкт-Петербурга.
«По-моему, нет особой сложности в наведении порядка с
использованием лекарственных растений в составе БАД. Вот несколько, на мой
взгляд, очевидных мер, которые следовало бы предпринять.
1) Разделить БАД и фитопрепараты по происхождению:
БАД, как правило, должны производиться из пищевого сырья (растений - в
частности), а фитопрепараты - из лекарственных трав. Для этого весь раздел
фитотерапии нужно выделить в отдельное направление, как это сейчас сделано с
гомеопатией. При этом значительная часть нынешних БАД на основе растительных
компонентов перейдет в раздел фитотерапевтических средств и должна будет
регистрироваться и отдельно от БАД, и - от ЛС, покрываемых медицинским
страхованием. Требования к ним по эффективности должны быть максимально
приближены к требованиям по эффективности ЛС, хотя уровень доказательности может
быть заведомо более низким (дань традициям, народной медицине). Те же препараты,
которые будут полностью отвечать стандартам доказательной медицины для ЛС,
смогут войти в клинические руководства на равных правах с синтетическими
лекарствами (впрочем, то же самое касается и любых возможных вмешательств,
включая и БАД, только для ЛС и фитопрепаратов условие подтверждения клинической
эффективности должно быть обязательным уже при регистрации).
2) Для любых других видов сырья, кроме пищевого,
должны существовать разрешительные перечни. Именно разрешительные, а не
запретительные. При этом должен быть обязательно прописан путь попадания в эти
перечни новых растений через установление допустимых норм потребления, также
разрешенного и ограниченного перечня биологически активных веществ с доказанной
полезностью. Это путь, начатый у нас нынешним МР 1915, а в Евросоюзе -
Директивой 46/2002. В установлении полезности главные роли должны играть
физиологи, а не врачи, т.е. нормативы должны устанавливаться по исследованиям
здоровых, а не больных людей. Нужна, видимо, какая-то постоянно действующая
комиссия по установлению уровней потребления тех или иных БАВ различными
группами людей. Разрешительные перечни автоматически отсекают пути проникновения
в состав БАД каких-либо экзотических непищевых растений. И еще важно, чтобы не
было одновременно списков разрешенных и запрещенных видов сырья, т.к. всегда
найдется что-то, чего нет ни в одном из списков, и тогда попадание такого
компонента в БАД будет зависеть от субъективного мнения эксперта, что сломает
любую систему регистрации.
Вот так я вижу данную проблему в целом, хотя понимаю, что существует и довольно
много частных вопросов, которые еще следует продумать отдельно. Но два
вышеперечисленных момента – принципиальные».
Российская пресса (журнал
«Компания») – о подделках БАД.
Анна Журина из «Диода» считает: «На рынке фармацевтики и биологически активных
пищевых добавок (БАД) подделки – абсолютное зло. Ведь в данном случае речь идет
не просто о финансовых потерях производителя. Гораздо опаснее то, что
потребитель не получит лечебного эффекта, на который он рассчитывал, приобретая
препарат, а то и навредит своему здоровью. Распознать подделку зачастую
непросто. Бывает, что на прием совершенно бесполезных пилюль уходят недели и
даже месяцы, за которые болезнь прогрессирует. Не дающая никакого эффекта
подделка вызывает негативное отношение ко всему классу БАДов в целом. Ведь
отечественный потребитель скорее решит, что это ушлые производители всучили ему
неработающую «пустышку», чем допустит мысль о том, что в аптеке могут
продаваться подделки. Многократно доказанное опытным путем правило о том, что
любой успешный товар рано или поздно пытаются подделать, действует и в
фармацевтической индустрии. И не просто действует, а по полной программе. Лично
я знаю пример совершенно сюрреалистичной ситуации, когда объем продаж подделок
лекарства одного из наших коллег по цеху превышал объем продаж «оригинала». Так
что «антипиратская» защита должна продумываться еще на стадии разработки
продукта. Мы в своих товарах используем несколько степеней защиты. Чем дороже
препарат – тем более продвинутая защита используется. Опыт показывает, что на
любом рынке действительно эффективным является только один способ борьбы с
фальсификатами: стоимость производства «качественной», то есть трудно отличимой
подделки должна быть настолько высокой, чтобы ее изготовление стало для
фальсификаторов экономически невыгодным. Недавно мы на десять месяцев задержали
продажу новой линии кремов для суставов, чтобы лучше отработать вопрос ее
защиты. Теперь все наши продукты – и таблетки, и желатиновые капсулы, и тубы с
кремами – упаковываются в блистеры. Такая упаковка значительно удорожает
изготовление подделки, поскольку предполагает использование весьма
дорогостоящего оборудования и специальной фольги. В нашей стране количество
мест, где можно изготовить такую фольгу, ограничено, а при ввозе из-за рубежа ее
необходимо декларировать. Поэтому любой поддельный блистер вычисляется по фольге
так же просто, как человек – по отпечаткам пальцев».
Комментарии к
продажам
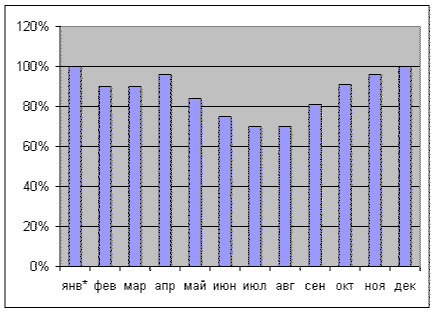
ДИНАМИКА ИЗМЕНЕНИЯ ОБЪЕМОВ ПРОДАЖ БАД В РФ (* январь 2005 г. – 100%)
CОПОСТАВЛЕНИЕ ОБЪЕМОВ ПРОДАЖ БАД ПО СРАВНЕНИЮ С СООТВЕТСТВУЮЩИМИ МЕСЯЦАМИ ПРЕДЫДУЩЕГО ПЕРИОДА Δ % (* январь 2005/январь 2004 г.)
Декабрь 05
В последнем месяце
года поставщики БАД на российский рынок совершили финишный рывок и вышли,
наконец, на уровень января-05, сравнявшись с ним по объемам (в стоимостном
выражении) продаж. То есть ноябрь превзойден на 4%. А это, в свою очередь,
означает, что продано на и 4% больше, чем в соответствующем месяце (декабре)
прошлого года, и есть даже предположение, за счет чего. Видимо, все больше
товара со складов производителей уходит не на аптечные полки, а в офисы и
подсобные помещения т.н. call-центров (другими
словами, «дистанционщиков») – технология сбыта работает у них, как часы, что не
преминуло отметить наше прогрессивное телевидение (оно же и помогает умельцам
дистанционных продаж «продвигать» продукцию). Итак, общий итог минувшего года –
в 7 месяцах из 12 продано больше, чем в 2004, в остальных – меньше. Но провалы
июля и августа не дали возможности рапортовать об общем росте годового сбыта –
рынок цивилизованных, разрешенных СанПиН продаж по-прежнему стагнирует, хотя
население, скорее всего, с каждым годов тратит все больше денег на приобретение
БАД.
"БАД-Бизнес",
декабрь 2005 г.
(в формате Microsoft Word)

|





